Oliver Sanchez
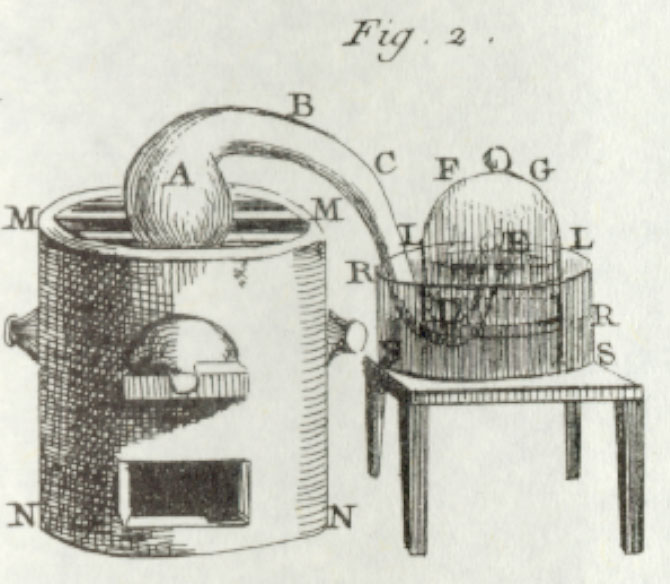
En 1770 Lavoisier realizó el experimento del
calentamiento del agua utilizando un aparato que condensaba el vapor y lo
devolvía al recipiente, sin perder un sólo gramo de agua. Pesó el agua y el
recipiente antes y después de realizar el experimento. Demostró que el peso del
matráz, del condensador y del agua seguía siendo el mismo antes y después de
una prolongada ebullición. Sin embargo, un sedimento terroso seguía
apareciendo. Extrajo y pesó el depósito formado, así como el matráz y comprobó
que la suma de ambos era igual al peso del matraz antes de iniciar la
experiencia. Es decir, el poso terroso provenía de una descomposición del
vidrio provocada por el calor.
Posteriormente, se ocupó de las reacciones químicas y comprobó que la masa (cantidad de materia) es algo permanente e indestructible, algo que se conserva pese a todos los cambios. Newton defendió antes en la física la idea de una masa que permanecía constante a través de todos los movimientos, y Lavoisier la aplicó al mundo de la química.
En 1774 Lavoisier enunció su ley de conservación de la masa, de forma que: en toda transformación química, la masa total de los reactivos que reaccionan es igual a la masa total de los productos de la reacción.
Así, según Lavoisier, en la reacción del cobre con el azufre para originar sulfuro cúprico, mediante:
Cu + S ® CuS
resulta que 4,00 g de Cu reaccionan con 2,02 g de S y producen 6,02 g de CuS.
Es decir, que: en una reacción química, la materia ni se crea ni se destruye, sólo se reorganiza.
Lavoisier comprobó su ley en numerosas reacciones, la mayoría de las cuales consistían en someter a calentamiento diversos metales, siempre en recipientes cerrados y con una cantidad determinada de aire, pero, sobre todo, midiendo las masas de las sustancias antes y después de la reacción. Estos experimentos le llevaron, no sólo a comprobar que el oxígeno del aire se combina con los metales durante la reacción de oxidación, sino también a demostrar la conservación de la masa duranrte el proceso.
La ley de Lavoisier hizo posible la aprarición de la ecuación química. La cual se sustenta en dos pilares, uno es la ley de Lavoisier y otro es la formulación moderna de los compuestos químicos, cuyos principios sistemáticos se deben a un conjunto de notables químicos, entre los cuales también destaca Lavoisier.
Posteriormente, se ocupó de las reacciones químicas y comprobó que la masa (cantidad de materia) es algo permanente e indestructible, algo que se conserva pese a todos los cambios. Newton defendió antes en la física la idea de una masa que permanecía constante a través de todos los movimientos, y Lavoisier la aplicó al mundo de la química.
En 1774 Lavoisier enunció su ley de conservación de la masa, de forma que: en toda transformación química, la masa total de los reactivos que reaccionan es igual a la masa total de los productos de la reacción.
Así, según Lavoisier, en la reacción del cobre con el azufre para originar sulfuro cúprico, mediante:
Cu + S ® CuS
resulta que 4,00 g de Cu reaccionan con 2,02 g de S y producen 6,02 g de CuS.
Es decir, que: en una reacción química, la materia ni se crea ni se destruye, sólo se reorganiza.
Lavoisier comprobó su ley en numerosas reacciones, la mayoría de las cuales consistían en someter a calentamiento diversos metales, siempre en recipientes cerrados y con una cantidad determinada de aire, pero, sobre todo, midiendo las masas de las sustancias antes y después de la reacción. Estos experimentos le llevaron, no sólo a comprobar que el oxígeno del aire se combina con los metales durante la reacción de oxidación, sino también a demostrar la conservación de la masa duranrte el proceso.
La ley de Lavoisier hizo posible la aprarición de la ecuación química. La cual se sustenta en dos pilares, uno es la ley de Lavoisier y otro es la formulación moderna de los compuestos químicos, cuyos principios sistemáticos se deben a un conjunto de notables químicos, entre los cuales también destaca Lavoisier.
El calentamiento del agua fue unos de los
grandes inventos fue descubierto en 1770 en un experimento en la actualidad
sirve para matar las bacterias , se utiliza para el oficio de la cocina , y
purificar , sirve para el cambiode estado y reacciones quimicas.
Otros de los descubrimientos fue que la masa
tiene materia por lo cual no se destruye ni se elimina solo se transforma entre
sus aportes esta la fisica, la astronomia , la quimica organica
Estos fueron algunos de los grandes aportes
del padre de la quimica.

 A los 30 años escasos,
A los 30 años escasos,